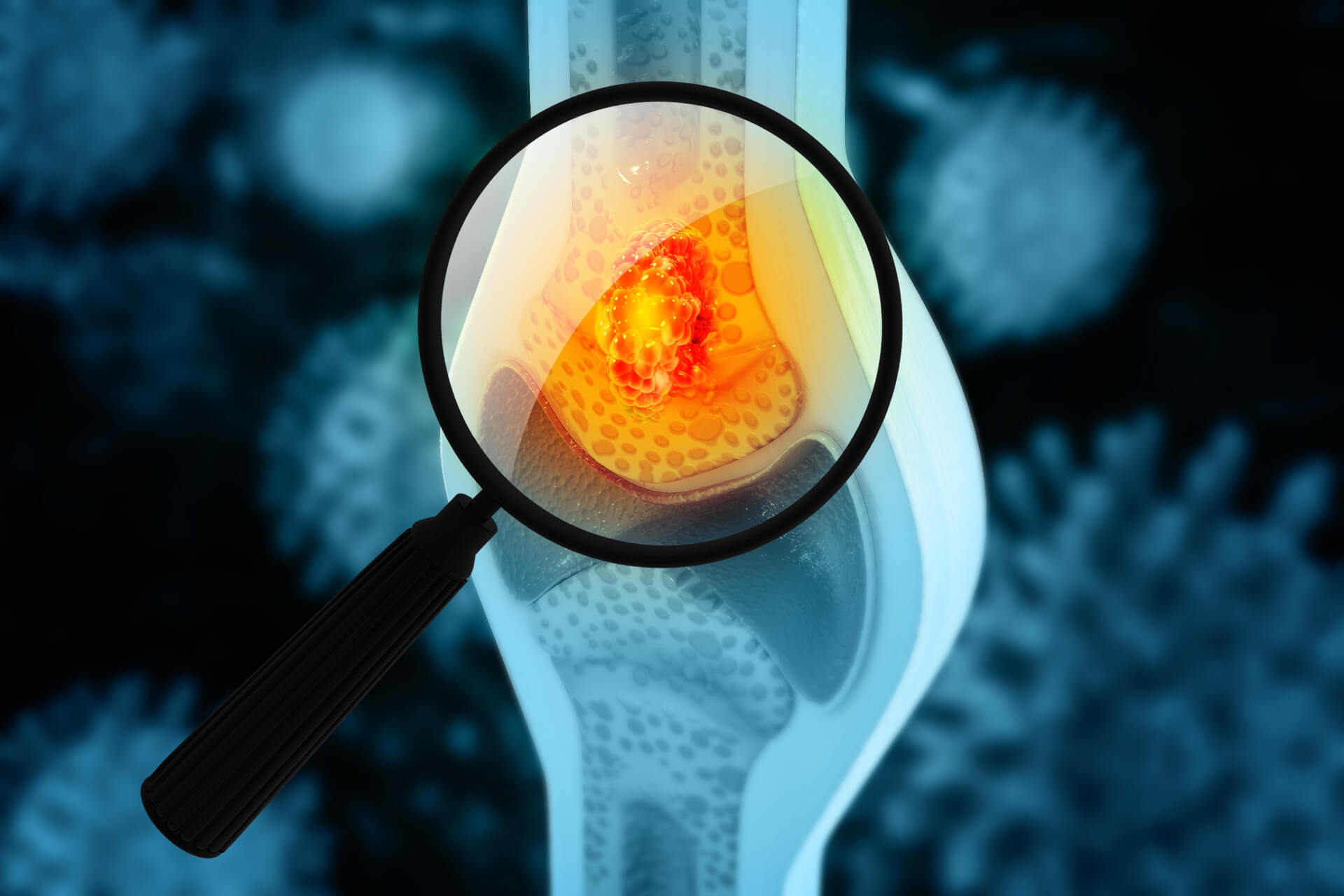
Knochensarkome
(ugs. Knochenkrebs)
Knochenkrebs (Knochensarkome): Definition, Entstehung und Häufigkeit
Knochenkrebs – unter diesem Begriff werden jene Tumore zusammengefasst, die ihren Ursprung unmittelbar im Knochengewebe haben. Der medizinische Sprachgebrauch für diese primären malignen (bösartigen) Knochentumore ist auch Knochensarkome. Sie können grundsätzlich überall am menschlichen Skelett entstehen.
Im Allgemeinen zählen Sarkome zu den eher seltenen Krebserkrankungen, sie machen lediglich rund ein Prozent aller tumorösen Erkrankungen in Deutschland aus. Unterschieden wird hier grob in zwei Hauptgruppen: in Weichteilsarkome mit einem Anteil von etwa 85 Prozent und in Knochensarkome mit einem deutlich geringeren Anteil von etwa 15 Prozent. Umgangssprachlich wird häufig der Begriff Knochenkrebs verwendet, im medizinischen Sprachgebrauch wird dieser Begriff weniger benutzt, hier spricht man von Knochensarkomen. Letzteres ist also der Knochenkrebs Fachbegriff.
Auch innerhalb der Gruppe der Knochensarkome gibt es teils beträchtliche Unterschiede im Hinblick auf Diagnostik, Behandlung und Heilungsprognose. Differenziert wird hier in Abhängigkeit der konkreten Lokalisation des Tumors sowie der Bösartigkeit. Beispiele für verschiedene Knochenkrebs Arten sind:
- Osteosarkome (oder allgemeiner Osteogene Tumoren),
- Ewing Sarkome (oder allgemeiner: Rundzelltumoren),
- Knorpelbildende Tumoren (zum Beispiel: Chondrosarkome),
- Sonstige Tumoren (zum Beispiel: Chordom).
Der häufigste maligne Knochentumor: das Osteosarkom
Das Osteosarkom ist nicht nur der häufigste bösartige Knochentumor, sondern tritt in aller Regel auch in hochaggressiver Form auf (konventionelle Osteosarkome). Diese Krebsart bildet noch unreife Knochensubstanz und schädigt auf diese Weise gesunde Skelettstrukturen. Betroffen sind vor allem Bereiche in der Nähe der Gelenke, mehrheitlich werden Tumoren am Knie lokalisiert. Die meisten Patientinnen und Patienten, die an einem Osteosarkom erkrankt sind, befinden sich noch in der Wachstumsphase. Besonders häufig tritt ein Osteosarkom bei Menschen zwischen 15 und 19 sowie zwischen sieben und acht Jahren auf. Ungefähr ein Drittel aller Patientinnen und Patienten sind über 30 Jahre alt.


Kontakt
Sie möchten sich über die Möglichkeiten der Protonentherapie am WPE informieren, oder direkt einen Termin vereinbaren?
Telefon: 0201 723 6600

Präzision und Effizienz: Vorteile der Protonentherapie bei Chordomen
Chordome gehören am WPE zu den am häufigsten bestrahlten Knochentumoren. Die sehr seltenen malignen Tumoren treten in der Regel im Bereich des Stammskelettes, meistens im Kreuz- oder Steißbein sowie an der Schädelbasis auf. Das Durchschnittsalter der betroffenen Patientinnen und Patienten liegt zwischen 50 und 70 Jahren. An einem Chordom der Schädelbasis können allerdings auch jüngere Menschen und Kinder erkranken.
Vor allem die Nähe des Sarkoms zum zentralen Nervensystem und Darmtrakt erschwert die Behandlung einer Hochdosisstrahlentherapie von über 70 Gy, die für eine dauerhafte Tumorkontrolle substantiell ist. Die Protonentherapie hat gerade bei Tumoren in der Nähe zu Risikoorganen und -strukturen enorme Vorteile: Sie ist hochpräzise, schont gesundes Gewebe bestmöglich und ist so effizient wie eine konventionelle Strahlentherapie.
Hochaggressiver Knochenkrebs des Kinder- und Jugendalters: Ewing-Sarkome
Die Sarkome der so genannten Ewing-Gruppe gelten ebenfalls als hochaggressiv und werden vor allem bei Kindern- und Jugendlichen diagnostiziert. Die Erkrankung ist nach dem New Yorker Krebsforscher James Ewing (1866-1943) benannt, der diesen Tumor im Jahre 1921 beschrieb.
Lediglich ein Fünftel aller betroffenen Patientinnen und Patienten ist älter als 20 Jahre, die meisten Diagnosen erfolgen im Alter zwischen zehn und 15 Jahren. Typische Körperregionen, an denen Tumoren auftreten, sind hier das Becken sowie der Bereich des Ober- und Unterschenkelknochens. Grundsätzlich kann sich ein Ewing-Sarkom jedoch – wie alle anderen Knochensarkome auch – überall am Körper entwickeln.
Ein kleiner Teil (etwa 15 Prozent) dieser Sarkom-Gruppe geht vom Weichteilgewebe des Körpers (Binde-, Fett- oder Muskelgewebe) aus ohne Beteiligung von Knochenstrukturen im Sinne eines extraskelettalen Ursprungs. Dennoch werden diese heutzutage gemäß den Standardprotokollen für Ewing-Sarkome behandelt.

Chondrosarkome bilden Knorpel- keine Knochensubstanz
Unter der Bezeichnung Chondrosarkom werden zahlreiche, äußerst heterogene bösartige Knochenkrebs Tumore gelistet, die stets aus dem Knorpelgewebe hervorgehen. Sie machen ca. 10 % aller Knochentumoren aus. Betroffen sind vor allem die Hüfte, das Becken und die Schulter. In manchen Fällen wird ein Chondrosarkom im Schädel- und Wirbelbereich diagnostiziert. Anders als das Osteo- oder Ewing-Sarkom treten die Tumoren dieser Gruppe seltener bei jungen Menschen, sondern vorwiegend bei Patientinnen und Patienten zwischen 40 und 70 Jahren auf.
Chondrosarkome wachsen zwar langsam, schädigen die Strukturen aber nachhaltig und streuen frühzeitig in andere Körperregionen bei einer höhergradigen Entartung.
Wie entsteht Knochenkrebs?
Knochenkrebs entsteht wie alle Krebsarten durch unkontrolliert wachsende, entartete Zellen. Bei Knochentumoren wachsen diese Zellen in den Knochen- oder Knorpelstrukturen des Körpers oder im Knochenmark. Das wuchernde Tumorgewebe verdrängt und zerstört das gesunde Gewebe, beispielsweise in den Bereichen der Gelenke oder den langen Röhrenknochen von Oberschenkel, Oberarm oder Schienbein. Einige Knochensarkom-Erkrankungen treten vor allem im Kinder- und Jugendalter auf, da sich die Skelettstrukturen zu diesem Zeitpunkt noch in der Wachstumsphase befinden.
Was sind die Ursachen für Knochenkrebs?
Bei den allermeisten Sarkomen ist die Ursache für ihre Entstehung bislang nicht bekannt oder nachvollziehbar. Diskutiert werden in Bezug auf die Entwicklung von Knochensarkomen jedoch verschiedene Risikofaktoren. Beispielsweise
- genetische Veranlagungen,
- Morbus Paget oder
- Strahlenbelastung im Sinne einer Strahlen-induzierten Zweittumorerkrankung.
Bei Ewing-Sarkomen lässt sich in den Tumorzellen eine bestimmte Chromosom-Veränderung feststellen. Diese ist nicht vererbbar und macht einen Nachweis der Erkrankung möglich. Zudem scheint es eine ethnische Prädisposition zu geben: Kaukasier erkranken laut aktueller Leitlinie relativ häufig an einem Ewing-Sarkom, während diese Krebsart in der afrikanischen Bevölkerungsgruppe so gut wie unbekannt ist.
Primäre und sekundäre Knochentumoren
Knochensarkome sind primäre bösartige Tumoren des Knochengewebes. Von so genannten sekundären Knochentumoren spricht man, wenn im Rahmen anderer Krebserkrankungen, beispielsweise bei Brust-, Lungen-, Prostata- oder Schilddrüsenkrebs, der jeweilige Tumor in das Knochengewebe gestreut hat.
Podcast PrO-Ton
Die Podcast-Reihe zur Protonentherapie am WPE soll Zuhörenden unser Zentrum und unsere Therapie auf persönlichere Weise näher bringen.
Wie häufig tritt Knochenkrebs auf?
Primärer Knochenkrebs gehört grundsätzlich zu den seltenen Krebserkrankungen. Laut Angaben der Deutschen Krebsgesellschaft (DKG) machen Knochensarkome bei erwachsenen Menschen gerade einmal ein Prozent aller bösartigen Krebserkrankungen aus. Knochenkrebs bei Kindern und Jugendlichen liegt mit etwa fünf Prozent etwas höher. Jungen und Männer erkranken im Durchschnitt dabei etwas häufiger an Knochenkrebs als Mädchen und Frauen. Die DKG geht deutschlandweit von insgesamt etwa 800 Neuerkrankungen pro Jahr aus. In über 50 Prozent aller Fälle werden dabei ein Osteo- oder ein Chondrosarkom diagnostiziert.
Was sind Anzeichen und Symptome von Knochenkrebs?
Obwohl sich die jeweiligen Anzeichen für Knochenkrebs je nach Art des Tumors und dessen Lokalisation unterscheiden können, gibt es durchaus einige typischen Knochenkrebs Symptome, die auf ein Knochensarkom hinweisen können. Dazu gehören:
- Schmerzen im Skelettsystem, auch unabhängig von Bewegungen und Belastungen, die oft zunächst etwa Wachstumsschmerzen oder Knochenentzündungen zugeordnet werden,
- Bewegungseinschränkungen,
- Knochenbrüche, die durch Instabilität der Knochen erfolgen und nicht etwa durch einen Unfall (pathologische Frakturen),
- Rezidivierende Entzündungen (Knochensarkome werden nicht selten primär als Osteomyelitis fehldiagnostiziert),
- Schwellungen der Weichteile (im fortgeschrittenen Verlauf der Erkrankung) sowie
- zusätzlich Fieber und Gewichtsverlust im Falle des Ewing-Sarkoms.
Die teils eher unspezifischen Symptome von Knochenkrebs, erschweren deren Bestimmung. Für eine sichere Diagnose ist daher auf jeden Fall das Fachwissen von Expertinnen und Experten eines spezialisierten Sarkomzentrum. gefordert.
Kann Knochenkrebs Metastasen bilden?
Die verschiedenen Krebsarten, die umgangssprachlich unter dem Begriff Knochenkrebs (oder fachlicher: Knochensarkome) zusammengefasst werden, gelten mehrheitlich als extrem aggressiv. Je früher Knochenkrebs diagnostiziert werden kann, desto besser ist daher die Prognose. Knochenkrebs streut in aller Regel auch in andere Bereiche des Körpers, wenn auch nicht immer gleich schnell und gleich stark. Etwa bei zehn bis 20 Prozent der Patientinnen und Patienten finden sich zum Zeitpunkt der Diagnosestellung bereits Tochtergeschwulste (Knochenkrebs Metastasen), meistens in der Lunge, in anderen Knochen oder im Knochenmark. Selbst wenn noch keine Metastasen vorliegen, sind zu diesem Zeitpunkt oft schon Tumorzellen im gesamten Körper nachweisbar; relativ häufig ist das zum Beispiel bei Osteosarkomen und Ewing-Sarkomen der Fall.
Knochenkrebs Diagnostik: Wie kann man Knochenkrebs erkennen?
Wie bei allen Krebserkrankungen geht auch die Diagnose von Knochenkrebs mit umfangreichen Untersuchungen einher, die interdisziplinäre Kompetenzen erfordern. Gefragt sind immer Expertinnen und Experten unterschiedlicher medizinischer Fachrichtungen. Idealerweise erfolgt die Diagnosestellung in einem auf Sarkome spezialisierten Zentrum.
Zu den notwendigen Untersuchungen gehören z. B.:
- Röntgen,
- Magnetresonanztomografie (MRT),
- Computertomografie (CT),
- Entnahme von Gewebeproben (Biopsie),
- Knochenszintigrafie (nuklearmedizinische Untersuchung zur Darstellung des Knochenstoffwechsels), ggf. PET/CT,
- Ultraschall.
Auf diese Weise werden Erkenntnisse zur Art des Tumors, zu dessen biologischer Aggressivität (Grading) sowie zum initialen Stadium (Staging) der Erkrankung gesammelt und ausgewertet. Erst dann kann – abhängig auch vom Alter und Gesundheitszustand des Patienten oder der Patientin – gemeinsam mit den Betroffenen die Auswahl der bestmöglichen Therapie erfolgen.
Welche Stadien gibt es bei einem Knochensarkom?
Sarkome sind sehr seltene Erkrankungen und durch die starke Differenzierung in Subtypen, tritt das jeweilige Sarkom noch einmal viel seltener auf. Somit ist eine Standardisierung, wie sie bei anderen Tumorarten vorgenommen werden kann, nicht immer möglich. Prinzipiell unterscheidet man bei Knochentumoren im Grading zwischen drei unterschiedlichen Abstufungen/Graden (G1 bis G3), abhängig davon, wie aggressiv der maligne Tumor ist und wie schnell er streut.
Die Bestimmung des jeweiligen Stadiums der Erkrankung (Staging) erfolgt nach den Kriterien
- Tumorgrad,
- Tumorgröße,
- Lymphknotenbefall und
- Stand der Metastasierung.
Geklärt werden müssen also folgende Fragen:
- Wie groß und wie aggressiv wächst das Sarkom?
- Sind Lymphknoten befallen oder nicht?
- Hat der Tumor bereits gestreut?
Auf diese Weise ergibt sich bei Knochenkrebs eine Einteilung in vier Stadien – von lokal begrenzten, kleineren Tumoren ohne Metastasierung bis hin zum fortgeschrittenen Stadium, in dem der Krebs bereits in andere Regionen des Körpers gestreut hat. Da sich die unterschiedlichen Knochenkrebs-Arten biologisch jedoch nicht immer einheitlich verhalten und unterschiedliche Körperregionen betreffen können, ist eine solche Unterteilung nicht immer ganz einfach.
- die Größe und Ausbreitung des Primärtumors (T)
- Fehlen oder Vorhandensein von örtlich oder benachbarten (regionären) Lymphknotenmetastasen (N)
- das Vorhandensein und die Lokalisation von Fernmetastasen (M)
| TNM für Knochentumoren | |
| TX | Primärtumor kann nicht beurteilt werden |
| T1 | Tumor 8 cm oder weniger in größter Ausdehnung |
| T2 | Tumor mehr als 8 cm in größter Ausdehnung |
| T3 | Diskontinuierliche Ausbreitung im primär befallenen Knochen |
| NX | Regionäre Lymphknoten können nicht beurteilt werden |
| N0 | Keine regionären Lymphknotenmetastasen |
| N1 | Regionäre Lymphknotenmetastasen |
| M0 | Keine Fernmetastasen |
| M1a | Lungenmetastasen |
| M1b | Andere Fernmetastasen |
| TNM Klassifikation Knochenkrebs nach UICC 2010 | ||||
| Stadium | Primärtumor | Lymphknotenstatus | Fernmetastasen | |
| Stadium IA | T1 | N0, NX | M0 | Niedriggradig |
| Stadium IB | T2 | N0, NX | M0 | Niedriggradig |
| Stadium IIA | T1 | N0, NX | M0 | Hochgradig |
| Stadium IIB | T2 | N0, NX | M0 | Hochgradig |
| Stadium III | T3 | N0, NX | M0 | Jeder Grad |
| Stadium IVA | Jedes T | N0, NX | M1a | Jeder Grad |
| Stadium IVB | Jedes T Jedes T | N1 Jedes N | Jedes M M1b | Jeder Grad Jeder Grad |
Beispiel für T1 N0 M0: kleiner Tumor ohne Lymphknotenbefall und ohne Fernmetastasen.

Sie haben ein Knochensarkom und suchen nach der passenden Therapie?
Wenn Sie an einem Knochensarkom erkrankt und auf der Suche nach einer geeigneten Therapie sind: Nehmen Sie mit unserem Case-Management Kontakt auf. Gemeinsam klären wir, ob eine Strahlentherapie mit Protonen für Sie in Frage kommt.
Case Management: 0201 723 6600 oder wpe@uk-essen.de
Knochenkrebs behandeln
Um herauszufinden, welche Therapie je nach Fall die jeweils bestmögliche und effizienteste ist, ist es wichtig, dass die konkrete Tumorart, das jeweilige Stadium der Erkrankung und der Malignität des Knochensarkoms bestimmt werden. Zudem haben Alter und Gesundheitszustand der Patientin oder des Patienten ebenfalls Einfluss auf die Therapieoptionen.
Gibt es Leitlinienbehandlungen für Knochensarkome?
So genannte Leitlinien geben Empfehlungen für Diagnose und Therapie verschiedener Erkrankungen. Sie stellen beispielsweise aufbauend auf medizinischen Erfahrungen und wissenschaftlichen Studienergebnissen Vor- und Nachteile unterschiedlicher Behandlungsoptionen gegenüber und zeigen mögliche Alternativen auf. Leitlinien müssen regelmäßig aktualisiert und neueren Erkenntnissen angepasst werden.
Folgende deutsche Leitlinien existieren für Knochenkrebs aktuell:
- Leitlinie für Osteosarkome,
- Leitlinie für die Behandlung von Ewing-Sarkomen bei Erwachsenen und bei Kindern sowie
- Leitlinie für maligne Knochentumoren des Erwachsenen.
Zudem gibt es so genannte Therapiestudien. Im Rahmen dieser Studien werden Menschen behandelt, die an einem Sarkom erkrankt sind. Ihr Ziel ist es, die Therapien immer weiter zu optimieren. Viele dieser Studien finden im Austausch mit internationalen Zentren und Organisationen statt. Für das Feld der Knochensarkome existieren beispielsweise diese Studien:
- EuroEwing als europäische Behandlungsprotokolle für Ewing-Sarkome mit der laufenden Studie iEuroEwing,
- Euro-B.O.S.S.-Protokoll für Osteosarkome (Cooperative Osteosarkom Studiengruppe = COSS in Zusammenarbeit mit ISG und SSG , der italienischen und skandinavischen Sarkom-Studiengruppe).
Wo kann Knochenkrebs am besten behandelt werden?
Die Behandlung von Knochenkrebs, also einer sehr seltenen Krebserkrankung, sollte immer in einem spezialisierten Sarkomzentrum erfolgen, in dem erfahrene Fachleute aus unterschiedlichen medizinischen Disziplinen zusammenarbeiten. Da insbesondere auch Jugendliche und Kinder von Knochenkrebs betroffen sind, sollten in diesen Fällen auch Fachleute der pädiatrischen Onkologie hinzugezogen werden. Universitätskliniken stellen hier in der Regel eine gute Anlaufstelle dar, weil sie interdisziplinär aufgestellt sind.
Wie können Knochensarkome (Knochenkrebs) behandelt werden?
Die Behandlung bei Knochensarkomen (Knochenkrebs) erfolgt in den meisten Fällen multimodal, das heißt, es werden verschiedene Therapieoptionen miteinander kombiniert. Das gilt insbesondere für hochgradig bösartige Knochentumoren wie Ewing- oder Osteosarkome.
Als Behandlungsmethoden zur Verfügung stehen in der Regel bei Knochenkrebs:
- chirurgischer Eingriff (Operation),
- Chemotherapie und
- Strahlentherapie.
Standardtherapie bei Knochentumoren ist die Operation, über die der Tumor im Idealfall vollständig entfernt werden kann. Gelingt die vollständige Resektion nicht oder hat der Krebs bereits gestreut, ist die Kombination mit einer Chemo- und/oder Strahlentherapie meist unerlässlich.
Bestrahlung und Chemotherapie können dabei
- im Vorfeld der Operation (neoadjuvant) oder
- im Anschluss (adjuvant) oder
- als definitives Konzept z. B. bei Inoperabilität bzw. nur als mutilierende Resektion möglich oder bei primär diffus gestreuter Tumorausdehnung erfolgen.
Strahlentherapie als Behandlungsmethode bei Knochenkrebs (Knochensarkomen)
Welche Behandlungsmöglichkeit bzw. welche Kombination bei der Therapie von Knochensarkomen die jeweils optimale ist, muss individuell von Fall zu Fall entschieden werden und hängt nicht zuletzt davon ab, welcher Sarkomsubtyp konkret diagnostiziert wurde. Denn nicht alle Arten reagieren gleich gut auf die Chemo- oder Strahlentherapie.
In vielen Fällen hat sich bei der Behandlung von Knochenkrebs eine Bestrahlung als Therapieoption bewährt. Chordome und Chondrosarkome zum Beispiel sprechen auf eine Chemotherapie oft nur schlecht an. Hier ist in vielen Fällen eine adjuvante oder definitive Strahlentherapie angezeigt. Bei der Behandlung von Ewing-Sarkomen hat die Strahlentherapie mittlerweile bereits einen festen Stellenwert, da diese Krebsart sehr sensibel auf Bestrahlung reagiert. Und auch bei Osteosarkomen kommt in Einzelfällen eine Strahlentherapie infrage. Hier sind dann allerdings besonders hohe Dosen notwendig, damit die Bestrahlung auch tatsächlich Wirkung zeigt.
Eine Strahlentherapie kann grundsätzlich präoperativ (neoadjuvant), postoperativ (adjuvant) oder als alleinige Lokaltherapie (definitiv) erfolgen. Als neoadjuvante Therapie im Vorfeld einer Operation dient sie dazu, die Größe des Tumors möglichst so weit zu verringern bzw. ihn soweit einzukapseln, dass ein chirurgischer Eingriff im Sinne einer vollständigen Resektion erleichtert und ohne Folgen beispielsweise für die Funktionstüchtigkeit von Armen und Beinen bleibt. Als adjuvante Therapie im Anschluss an die Operation besteht ihr Ziel darin, die Gefahr eines Rückfalls und erneuten Auftretens des Tumors (Rezidiv) möglichst verhindern.
Als alleinige Methode wird eine Bestrahlung in der Regel nur bei inoperablen Tumoren eingesetzt oder wenn eine onkologisch vollständige Operation mit zu großen Risiken oder Funktionseinbußen verbunden wäre, beispielsweise, weil eine Amputation von Gliedmaßen notwendig würde.
Da die Behandlung von Knochenkrebs an besonders schwierigen und sensiblen Lokalisationen des Körpers – im Beckenbereich, in der Schädelbasis, der Kopf-Hals-Region oder an der Wirbelsäule – sehr herausfordernd ist, wird auch die Strahlentherapie bei der Behandlung von Knochenkrebs immer wichtiger.
Internationale Studie SACRO
Seit Dezember 2019 verantwortet das WPE die deutschlandweite Umsetzung der internationalen SACRO Studie, die von der italienischen Sarkom-Gruppe (Italian Sarcoma Group) initiiert wurde. Gegenübergestellt werden hier die Wirksamkeit zweier unterschiedlicher Methoden für die Behandlung von Chordomen des Kreuzbeins: die definitive Strahlentherapie gegenüber einem chirurgischen Eingriff evtl. gefolgt von einer adjuvanten Strahlentherapie. Beide Verfahren sind derzeit in der Therapie von lokal begrenzten Chordomen des Kreuzbeins üblich. Bis dato wurden insgesamt über 60 Patienten in die jeweiligen Untersuchungsgruppen eingeschlossen. Weitere Informationen zur Studie unter
Protonentherapie als optimale Behandlungsalternative bei Knochensarkomen (Knochenkrebs)
Aufgrund der räumlich oftmals ausgedehnten Strahlenbelastung bleibt eine Strahlentherapie nicht gänzlich ohne Nebenwirkungen. Gerade konventionelle Bestrahlungsmethoden wie eine Bestrahlung mit Photonen belasten das umliegende (gesunde) Gewebe des Sarkoms oftmals mit. Das kann bei schwierigen anatomischen Lagen, wenn der Tumor beispielsweise von wichtigen Organen umgeben ist, zur Bildung von Zweittumoren und anderen Komplikationen führen. Um diese Risiken zu umgehen, empfiehlt sich eine Protonentherapie als alternatives schonendes Bestrahlungsverfahren bei Knochenkrebs. Denn die Bestrahlung mit Protonen ist bei gleichen Heilungschancen mit potenziell weniger Nebenwirkungen verbunden.
Tatsächlich sind die aktuellen wissenschaftlichen Erkenntnisse zur Protonentherapie von Knochenkrebs sehr vielversprechend, zum Beispiel bei der Bestrahlung von Chordomen und Chondrosarkomen. Die Protonentherapie ist deshalb bereits optionaler Bestandteil vieler multidisziplinärer Therapiekonzepte und wird bei der Behandlung von Kindern und Jugendlichen oder Tumoren der Körperachse mittlerweile explizit empfohlen. Gerade bei inoperablen Tumoren oder solchen Sarkomen, die nicht vollständig chirurgisch entfernt werden können, ist die Bestrahlung mit Protonen eine ergänzende oder auch definitive (alleinige) Behandlungsoption.
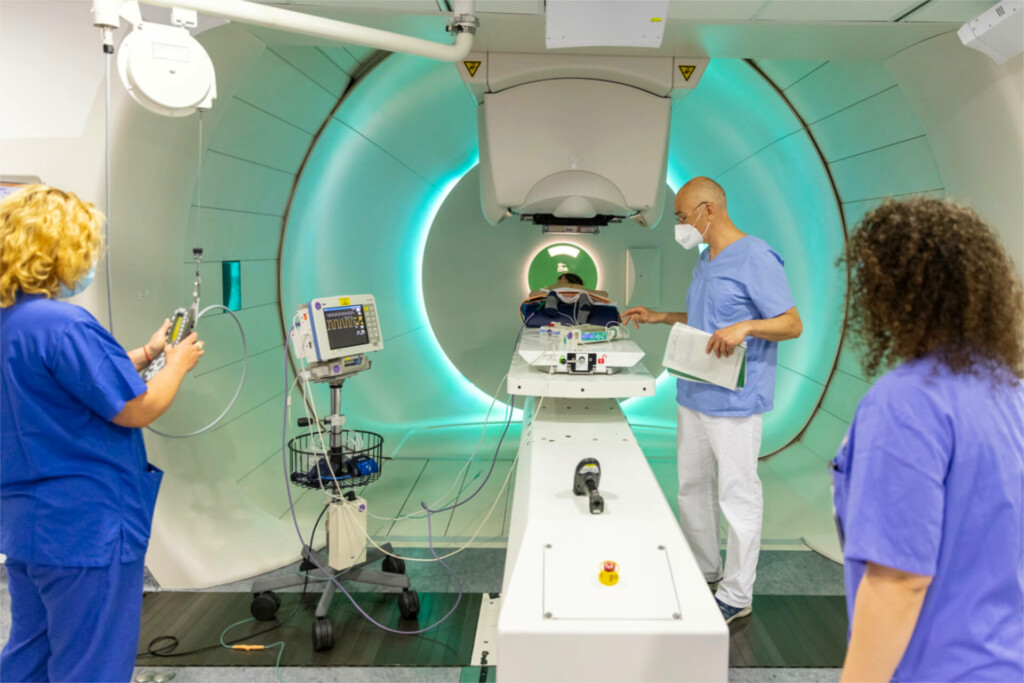
Was sind die Vorteile einer Protonentherapie?
Als innovatives Verfahren ermöglicht die Protonentherapie eine hochkonformale Dosisverteilung. Konformal bedeutet, dass die Bestrahlung die (unregelmäßigen) Strukturen des Sarkoms aufgreift und das Bestrahlungsfeld so aufgebaut und ausgerichtet ist, dass das um den Tumor liegende gesunde Gewebe bestmöglich geschont wird. Das ist gerade dann wichtig, wenn der Tumor in einer sensiblen Körperregion liegt, wenn hohe Strahlendosen notwendig sind oder wenn die zu behandelnden Patientinnen und Patienten noch sehr jung sind. Denn gerade Kinder sind aufgrund ihres unreifen Gewebes besonders anfällig für strahlenbedingte Spättoxizitäten und sekundäre Malignome.
Als Vorteil ausspielen kann diese hochmoderne Art der Strahlentherapie dabei vor allem die außerordentlichen physikalischen Eigenschaften der Protonen:
- Protonen machen eine enorm präzise Bestrahlung möglich und können auch tiefliegende Tumoren millimetergenau erreichen.
- Sie geben auf ihrem Weg zum Tumor nur wenig Strahlung an gesundes Gewebe ab.
- Sie lassen sich gezielt abbremsen und schonen auf diese Weise auch das gesunde Gewebe hinter dem Tumor.
Auf diese Weise reduziert die Protonentherapie das Risiko sowohl für eine akute als auch für eine langfristige Schädigung sensibler Organe, Nerven oder anderer Risikostrukturen im Körper.
Mit Blick auf die Behandlung von an Knochentumoren erkrankten Kindern und Jugendlichen bedeutet das:
- Die Bestrahlung mit Protonen schont das bei Kindern sich noch entwickelnde, äußerst strahlensensible Normalgewebe bestmöglich.
- (Mit-)Bestrahlungen von Knochen können unmittelbar zu Fehlhaltungen, Verkrümmungen und mangelhaftem Knochenwachstum und damit zu Wachstumsstörungen führen. Die Präzision der Protonentherapie minimiert ein solches Risiko.
- Zugleich wird auch die Gefahr von späteren Zweitmalignomen (Rezidive) und strahlenbedingten Langzeitfolgen reduziert.
Welche Nebenwirkungen hat die Protonentherapie von Knochensarkomen?
Eine Bestrahlung ist mit Nebenwirkungen verbunden, ganz gleich, ob konventionell mit Photonen oder mit Protonen bestrahlt wird. Bei der Protonentherapie handelt es sich jedoch um eine lokale Therapiemaßnahme, die ihre Wirkung nicht im gesamten Körper, sondern nur in der vorab definierten Region um den Tumor entfaltet. Daher treten mögliche Begleiterscheinungen auch meist nur in diesen Regionen auf. In der Regel bessern sich die Symptome wenige Wochen nach der Bestrahlung. Zudem fallen die Nebenwirkungen aufgrund der Zielgenauigkeit, mit der die Tumorregion bestrahlt wird, deutlich geringer aus als bei einer herkömmlichen Strahlentherapie.
Unter anderem sind folgende akuten Nebenwirkungen möglich:
- Reizerscheinungen der bestrahlten Haut,
- Haarausfall (bei einer Bestrahlung des Kopfes),
- Müdigkeit,
- selten Übelkeit und Erbrechen.
Kann die Protonentherapie mit anderen Behandlungsmethoden kombiniert werden?
Die Protonentherapie kann ebenso wie eine konventionelle Bestrahlung mit Photonen mit anderem Therapieoptionen kombiniert werden – beispielsweise mit einer Chemotherapie (Radio-Chemotherapie).
Sie kann vor oder im Anschluss an eine Operation erfolgen oder stellt in Einzelfällen eine grundsätzliche Alternative zu einem chirurgischen Eingriff dar.
Protonenbestrahlung am WPE der Universitätsmedizin Essen
Das Westdeutsche Protonentherapiezentrum Essen (WPE) gilt als eines der fortschrittlichsten Protonentherapiezentren der Welt und eines der führenden Zentren in der Protonenbestrahlung von Sarkomen. Als Teil des von der DKG zertifizierten Sarkomzentrums der Universitätsmedizin Essen behandeln wir Tumoren, die aufgrund ihrer Lage oder des jungen Alters der Patientinnen und Patienten eine extrem genaue Bestrahlung erfordern.
Dies geschieht stets in fachübergreifender Zusammenarbeit und über die Teilnahme an interdisziplinären Tumorkonferenzen gemeinsam mit den Kliniken der Universitätsmedizin Essen und mit dem Westdeutschen Tumorzentrum Essen (WTZ). Das WTZ ist das älteste und zugleich eines der größten Tumorzentren Deutschlands sowie eines von nur 13 anerkannten deutschen Spitzenzentren für Tumorforschung, -diagnostik und -therapie nach dem US-amerikanischen Vorbild eines Comprehensive Care Centers (CCC). Es verfügt über eine OnkoZert-Zertifizierung und ist in das Deutsche Konsortium für Translationale Krebsforschung (DKTK) eingebunden.
Unsere Erfahrung spricht für sich: Denn obwohl Sarkome selten sind, behandeln wir diese Krebsart am WPE sehr häufig. Etwa bei gut einem Viertel unserer bisherigen Patientinnen und Patienten haben wir ein Sarkom bestrahlt. Sie können daher auf unsere umfassende Expertise vertrauen – und das nicht nur im Erwachsenenalter. Gerade bei Kindern, die noch im Wachstum sind, kann eine Protonentherapie am WPE ihr volles Potenzial ausspielen.

Sie haben Fragen zur Protonentherapie bei Knochensarkomen am WPE?
Sprechen Sie uns an. Durch unsere umfangreiche Erfahrung und die enge Abstimmung im interdisziplinären Team bieten wir Ihnen eine individuelle Behandlung auf höchstem internationalem Niveau.
Case Management: 0201 723 6600 oder wpe@uk-essen.de
Welche Knochensarkome werden am WPE behandelt?
Indikationen für eine Protonentherapie am WPE sind unter anderem folgende Tumorarten:
Knochen- und Knorpeltumoren
- Chordom,
- Chondrosarkom,
- Ewing-Sarkom/PNET,
- Osteosarkom,
- Osteoblastom,
- Chondromyxoidfibrom,
- Chondroblastom,
- Sarkom mit BCOR-Genveränderung.
intrakranielle Sarkome (Tumoren innerhalb des Schädels)
- ZNS sarkomatoider Tumor,
- Gliosarkom,
- ZNS Ewing/PNET,
- ZNS RMS,
- ZNS undifferenziertes Sarkom,
- Spindelzellsarkom ZNS,
- Sarkom (NOS)(ZNS),
- CNS EFT-CIC,
- DICER 1.
Das WPE steht für Kompetenz und Erfahrung vor allem in der pädiatrischen Onkologie
Die Protonenbestrahlung von Patientinnen und Patienten im Kindes- und Jugendalter ist einer der ausgewiesenen Schwerpunkte des WPE. Durch Zuweisungen aus ganz Deutschland, Europa und darüber hinaus behandeln wir jährlich bis zu ca. 300 Kinder und Jugendliche im Alter von bis zu 18 Jahren, über die Hälfte unserer jungen Patientinnen und Patienten ist unter sieben Jahre alt ist. Gemessen an der relativ geringen Häufigkeit kindlicher Tumore ist das im europäischen Vergleich ein hoher Anteil. Da Tumoren bei Kindern zudem in vielfältiger Form in Erscheinung treten, haben wir über die Jahre hinweg eine fundierte Fachkompetenz im Bereich der Strahlentherapie bei Kindern aufgebaut.
Wir bestrahlen grundsätzlich nach standardisierten Therapieprotokollen, an deren Optimierung wir im Rahmen von klinischen Studien – etwa der Gesellschaft für Pädiatrische Onkologie und Hämatologie (GPOH) maßgeblich mitarbeiten.
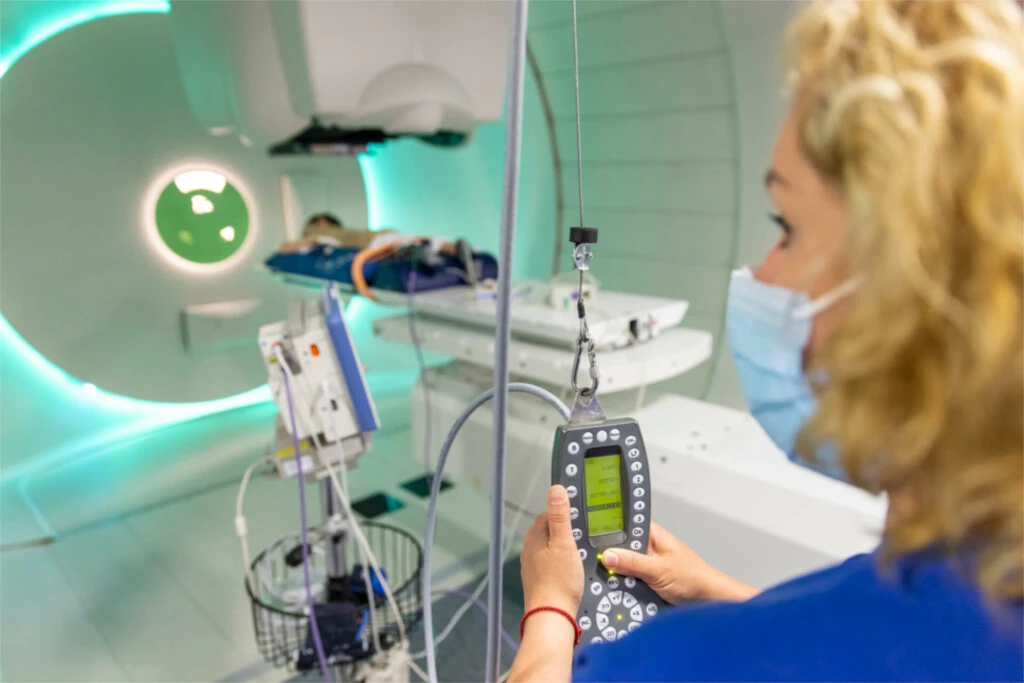
Pencil Beam Scanning – die fortschrittlichste Art der Protonentherapie
Das WPE nutzt die fortschrittlichste Art der Protonentherapie – das Pencil Beam Scanning. Bei dieser Technik bestrahlen wir ein Knochensarkom mit einem bleistiftspitzendünnen Strahl, den wir Punkt für Punkt über den gesamten dreidimensionalen Raum des Tumors steuern. Auf diese Weise bestrahlen wir nahezu ausschließlich das erkrankte Gewebe und schonen die umliegenden Regionen bestmöglich. Des Weiteren nutzen wir weitere Formen der Protonentherapie wie das Uniform-Scanning und Passive Scattering. Damit bieten wir eine Vielzahl an Technologien an, mit denen wir für nahezu jede Situation eine individuelle Protonenstrahlentherapie erarbeiten können, verbunden mit so wenig Nebenwirkungen wie möglich.

Sie haben Fragen zur Protonentherapie bei Knochensarkome am WPE?
Sprechen Sie uns an. Durch unsere umfangreiche Erfahrung und die enge Abstimmung im interdisziplinären Team bieten wir Ihnen eine individuelle Behandlung auf höchstem internationalem Niveau.
Case Management: 0201 723 6600 oder wpe@uk-essen.de
Wer kann mit der Protonentherapie am WPE behandelt werden?
Am WPE bieten wir Patientinnen und Patienten aus Deutschland und dem Ausland die Möglichkeit einer nebenwirkungsarmen Tumortherapie an. Dies geschieht in Zusammenarbeit mit den Kliniken der Universitätsmedizin Essen und dem Westdeutschen Tumorzentrum (WTZ), also mit allen für die Behandlung notwendigen Fachdisziplinen. Von dieser gebündelten onkologischen Expertise profitieren alle Patientinnen und Patienten des WPE, insbesondere aber jene, deren Heimatklinik weit entfernt ist und die onkologische Kompetenz vor Ort benötigen.
So ist beispielsweise eine parallele Chemotherapie am Universitätsklinikum Essen möglich. Grundsätzlich kann diese jedoch auch am Heimatkrankenhaus erfolgen. Wir behandeln in der Regel Patientinnen und Patienten jeden Alters. Ob eine Protonentherapie letztlich in Frage kommt, wird individuell je nach Fall entschieden.
Psychosoziale Versorgung
Das psychosoziale Team des WPE unterstützt Sie und Ihre Familie während der Zeit der Strahlentherapie optimal. Das Team übt gemeinsam mit Ihrem Kind spielerisch die Elemente der Behandlungssituation ein und etabliert zudem kleine Belohnungsrituale während der eigentlichen Therapie. So nehmen wir Ihnen und Ihrem Kind mögliche Ängste und machen Ihrem Kind die Behandlung am WPE so angenehm und einfach wie irgend möglich. Mehr zu diesem Konzept erfahren Sie auf dieser Seite.
Wie sieht der Behandlungsablauf am WPE aus?
Sollten Sie sich für die Knochensarkome mit Protonen am WPE interessieren, stellen Sie oder Ihr behandelnder Arzt bzw. Ihre Ärztin zuallererst eine Therapieanfrage an uns.
Unser Case-Management-Team nimmt die Anfrage dann entgegen und steht von da an für Sie als Ansprechperson zur Verfügung. Fragen, die vom Case-Management nicht beantwortet werden können, leitet dieses umgehend an die behandelnden Ärzte und Ärztinnen weiter. Nach der Therapieanfrage ist der Ablauf wie folgt:
Wenn uns alle relevanten Informationen und Dokumente vorliegen, entscheidet das zuständige ärztliche Team, ob eine Protonenbestrahlung bei Ihrem Knochensarkom sinnvoll ist. Ihre individuelle Anfrage wird zudem mit den Kolleginnen und Kollegen aus anderen relevanten Fachdisziplinen der Universitätsmedizin Essen und im interdisziplinären Onkologie-Tumorboard besprochen – einer Gesprächsrunde aus fachlich versierten Expertinnen und Experten. Gegebenenfalls werden Ihnen im Anschluss auch alternative Behandlungsoptionen empfohlen.
Sollte sich das Expertenteam zur Behandlung Ihres Knochensarkoms mit der Protonentherapie entscheiden, beginnt die Therapieplanung. Hierfür laden wir Sie und wenn gewünscht auch einen Angehörigen oder eine Angehörige zu einem Termin ein. In diesem erläutern wir Ihnen ausführlich die Chancen und Risiken der Protonenbestrahlung bei Knochensarkomen.
Nach Ihrem Einverständnis zur Protonenbestrahlung beginnen die Vorbereitungen der Therapie mit den folgenden Schritten:
- Anfertigung einer individuellen Lagerungshilfe, damit Ihr Knochensarkom in jeder Bestrahlungssitzung exakt mit Protonen bestrahlt werden kann.
- Nutzung bildgebender Verfahren, wie beispielsweise CT und gegebenenfalls auch MRT, damit unser ärztliches Team und die Medizinphysiker und Medizinphysikerinnen des WPE die genaue Lage Ihres Tumors und der umliegenden Organe beurteilen können.
Nach der Planung und Qualitätssicherung beginnt ein bis zwei Wochen später schließlich die tägliche Protonentherapie. Die Sitzungen finden ambulant statt und gehen im Rahmen der Studien über einen Zeitraum von etwa fünf bis sieben Wochen. Die einzelne Strahlenbehandlung dauert dabei meist nicht länger als eine halbe Stunde, wobei die eigentliche Protonenbestrahlung sogar nur wenige Minuten in Anspruch nimmt.
Welche Informationen sind für die Erstvorstellung nötig?
Sollten Sie sich für eine Protonenbestrahlung Ihres Knochensarkoms interessieren, benötigen wir für die Prüfung folgende Dokumente:
- den Histologiebefund,
- radiologische Befunde,
- einen zusammenfassenden Arztbericht,
- OP-Berichte,
- aktuelle CT- und/oder MRT-Bilder,
- Pathologiebefunde,
- Ggf. auswärtiger Tumorboardbeschluss.
Diese Unterlagen können entweder Sie selbst einreichen oder Ihr behandelnder Arzt oder Ihre Ärztin. Auf Basis der vorliegenden Dokumente entscheiden unsere Radioonkologinnen und -onkologen dann, ob eine Protonentherapie bei Ihnen möglich ist. Sollte dies der Fall sein, benötigen wir zu einem späteren Zeitpunkt wahrscheinlich weitere Dokumente. Gegebenenfalls fordern wir auch weitere Untersuchungen an, um eine optimale Therapieplanung durchzuführen.
Unser Case-Management informiert Sie oder Ihren behandelnden Arzt/Ihre behandelnde Ärztin in jedem Fall rechtzeitig darüber, so dass die Therapie zeitnah beginnen kann.
Kostenübernahme der Protonentherapie
Mit diversen gesetzlichen Krankenkassen haben wir Verträge zur Übernahme der Kosten einer Protonentherapie bei Knochensarkomen geschlossen. Mit anderen und auch mit einigen privaten Krankenkassen haben wir Abläufe zur Kostenübernahme etabliert. Wir unterstützen alle Patientinnen und Patienten bei der Kostenklärung direkt von Beginn an.
Kontaktaufnahme
Sie möchten sich über die Protonentherapie Ihres Knochensarkoms am WPE informieren? Oder direkt einen Termin machen? Dann nutzen Sie unsere nachfolgenden Kontaktmöglichkeiten.
Jede neue Kontaktaufnahme erfolgt über unser erfahrenes und engagiertes Case-Management – der Schnittstelle zwischen Ihnen und unserem Team. Es unterstützt Sie bei
- der Zusammenstellung Ihrer Unterlagen,
- bei der Kostenübernahme,
- bei Reise und Unterkunft
und beantwortet alle Ihre aufkommenden Fragen. Es stellt auch den Kontakt zu unseren Strahlentherapeuten und -therapeutinnen her.
